자료실
Gateway to Electrochemistry
Gateway to Electrochemistry
Which type of sample mount is better, magnetic screw or other?
- Screw mount : 높은 유속 허용, flow 모드에서 셀을 사용하려는 경우 추천
- Magnetic mount : 빠른 샘플 장착, static 모드에서 셀을 사용하려는 경우 추천
출처 : ALS co., Ltd
The reference of the potential in electrochemical measurement is based on the reference electrode, so it is a very important electrode.
ALS has a wide line of reference electrodes, as reference electrode for measurement in aqueous solution, non-aqueous solution, alkaline solution, and reversible hydrogen electrode. Also, the reference electrode has the standard size, which makes possible to fit in all of our accessories.
Furthermore, to complete the line up, we have the screw type, which could be used in our Cross flow cell, Radial flow cell, EQCM flow cell and SEC-Spectroelectrochemical flow cell.
Below is a quickly tool to select the reference electrode for your measured sample:
• 작업전극(working electrode)은 전기화학 실험에서 관심 있는 반응이 일어나는 전극을 의미하며 전극에서 일어나는 반응이 산화반응인지 환원반응인지에 따라 음극
또는 양극으로 불리기도 함.
• 적합한 작업전극은 여러 조건에 의해 결정되는데 사용 가능한 전위 범위, 전자전달반응의 kinetic 등에 의해 결정됨.
• 비수용성 용액에서는 수소 또는 산소과전압은 영향을 주지 않지만 비수용성 용매와 지지전해질의 분해전위가 전극 결정의 주요 요인이 됨. 또한, 용매 내에 불순물로
존재하는 물(water)의 양에 따라 전위창(potential window)이 좁아지는 현상이 있음.
• 작업전극 선택 시 고려할 점
- 전자 전달이 빠르고 재현성 있게 실험이 될 것
- 주어진 전해액에 대해 넓은 전위창(potential window)을 가질 것
- 가격이 저렴할 것
- 실험이 거듭됨에 따라 전극 표면을 초기 상태와 같도록 유지하기 위한 전극 표면 처리가 용이할 것
- 독성이 없을 것
• 기준전극을 개봉하였을 경우 (씰링 또는 캡을 벗겨낸 경우) 기준전극의 보관은 기준전극 내부용액과 동일한 용액(농도)을 사용
• 전극 내부 용액과 같은 농도의 용액에 전극을 담궈 전극 tip이 젖은 상태로 보관함. 단, 전극 전체가 용액에 잠기지 않도록 주의
• 주기적으로 기준전극의 내부 용액을 새로운 용액으로 교체하여 사용하는 것이 바람직함.
• NOTE : 일부 제품은 용액에 보관하는 것을 추천하지 않으므로 사용하는 제품의 메뉴얼 참고.
기준전극의 내부 용액이 포화 KCl인 전극은 온도에 따라 결정이 생길 수 있으나 제품에 이상은 없습니다.
결정을 제거하기 위해 아래 동영상을 참고해 주십시오. 만약 동영상의 방법으로도 결정이 완전히 없어지지 않는다면 순수를 전극 안에 조금씩 채워서 결정을 없애준 다음, 전극 안의 용액을 버리고 새 용액으로 채워 주십시오. (주사기를 이용하여 새 포화 KCl 용액을 채워준 후 반드시 순수로 주사기를 세척해 주십시오. KCl 용액이 마르면서 주사기 입구를 막아 버릴 수 있습니다.)
낮은 실온에서 실험할 경우 결정은 다시 생길 수 있습니다.
기포가 커서 내부 이온 이동 경로를 완전히 막는 경우 실험 시 전압 제어가 되지 않아 과전류가 흐를 수 있으며 기포가 작게 방울방울 있는 경우 실험 시 노이즈가 발생할 수 있습니다. 전극에 기포가 생긴 경우 아래 동영상을 참조하시어 제거해 주시기 바랍니다.
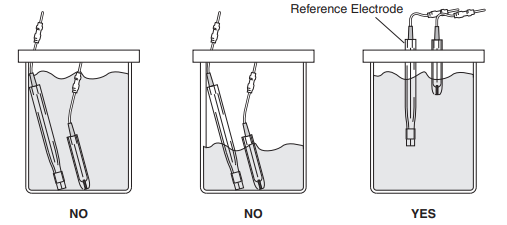
• 준비물 : 전압계(voltmeter), 사용하던 전극, 같은 종류의 다른 전극, 비커, 전극 내부 용액으로 쓰인 용액(같은 농도로 준비)
• 아래 그림과 같이 연결 후 두 전극 사이의 potential 차이를 전압계를 이용하여 측정.
• 이상적으로는 같은 종류의 전극이라면 두 전극의 potential 차이는 0(zero)이여야 하나 실제로는 약간의 차이가 나게 됨.
• 두 전극의 potential 차이가 0 ± 20 mV라면 사용하는데 문제가 없는 것으로 보아도 무방함.
• 만약 두 전극의 potential 차이가 상당히 크게 나타난다면 같은 종류의 또 다른 전극을 준비하여 위의 두 전극 중 어느 것에 문제가 있는지 확인하도록 함.
• 만약, Ag/AgCl 기준전극(Ag/AgCl/NaCl(3M))과 Calomel 기준전극으로 짝을 이뤄 테스트를 진행한다면 Calomel 기준전극을 전압계의 black(negative) 단자에 연결하고,
두 전극의 potential 차이가 –35 ± 20 mV 값이라면 문제 없다 판단할 수 있음.

상대전극은 전기화학 cell에서 전하가 이동할 수 있도록 전기적 회로를 완성시키는 역할을 합니다. 작업전극에서 일어나는 반응에 영향을 주지 않도록 백금, 금과 같은 귀금속이나 탄소 재질이 주로 사용되며 실험과 응용에 따라 니켈, 강철(steel) 등 다양한 재질이 사용되고 있습니다. 다음은 상대전극 사용에 있어 몇 가지 유념해야 할 내용들을 정리해 보았습니다.
상대전극(counter electrode)은 보조전극(auxiliary electrode)라고도 불립니다. 보조전극이라는 표현에 쓰인 ‘보조’라는 단어 때문에 상대전극이 ‘예비의’ 또는 ‘부가적인’ 것을 의미한다고 생각할 수 있으나 전기화학 실험에서 상대전극은 꼭 필요한 요소입니다. 예를 들어, 전류를 제어하며 전압을 측정하고자 하는 실험의 경우 최소 2개의 전극이 필요한데 하나는 작업전극이고 나머지 하나가 상대전극입니다.
작업전극은 관심있는 반응이 일어나는 전극이고 이때 짝을 이룬 전극이 상대전극입니다. 작업전극과 상대전극만을 사용하는 2전극 실험에서는 이 둘을 서로 구별하는 것이 쉽지 않을 수 있습니다. 그러나, 기준전극을 사용하는 3전극 실험에서는 작업전극과 상대전극이 확실히 구분될 수 있습니다. 하나의 단자에 상대전극과 기준전극을 함께 연결하고 다른 쪽 단자에는 작업전극을 연결하여 potentiostat로 2전극 실험을 하는 경우에도 작업전극과 상대전극은 확실히 구분될 수 있습니다. 이를 위해 작업전극 및 상대전극과 potentiostat와의 관계를 이해할 필요가 있습니다.
전류는 작업전극을 통해 상대전극으로 흐르게 됩니다. 산화환원반응은 항상 짝을 이뤄 일어나며 만약 환원반응이 작업전극에서 일어난다면 산화반응이 상대전극에서 일어나게 됩니다. 이때 우회하는 유로(flow path)는 없으며 전류는 상대전극과 작업전극 사이에서만 흐르게 되며 양쪽 전극에서의 전하량은 동일합니다. 상대전극에서 일어나는 반응의 과전압이 커지는 상황을 가정해 보겠습니다. 상대전극에서의 이러한 상황이 작업전극에서 일어나는 반응을 제한하는 요인이 될 수 있습니다. 이러한 문제를 해결하기 위해서는 상대전극에서의 전류 밀도를 감소시키야 합니다. 달리 표현하면, 상대전극의 면적을 작업전극의 면적보다 크게 만드는 것이 바람직합니다. 그렇지 않으면, 상대전극의 과전압은 커지고 결과적으로 potentiostat가 허용하는 전압 출력 범위를 초과하게 됩니다. 특히, 전기분해 전류(electrolysis current)가 증가하는 실험이라며 이를 주의해야 합니다.
potentiostat를 이용할 경우 작업전극의 전위는 기준전극에 대해 조절 가능합니다. 그러나 상대전극의 전위는 알 수 없으며 보통의 경우 관심사가 아니기도 합니다. 상대전극의 전위는 작업전극의 전류 값에 따라 변하게 됩니다. 작업전극에서 반응이 원활히 일어날 수 있도록 그 반대쪽인 상대전극 쪽에서의 반응이 충분히 일어나지 않는다면 상대전극에서의 과전압이 증가하게 될 것입니다. 이러한 이유로 상대전극의 반응면적은 가능한 커야 하고 전류밀도는 낮아야 합니다.
상대전극에서 생성된 생성물이 관심있는 반응에 영향을 끼칠 수 있는 가능성에 대해 우려하는 경우가 있기 때문에 혹자는 상대전극을 적업전극으로부터 분리하기를 원하기도 합니다. 특히, bulk electrolysis 실험에서 작업전극에서 생성된 생산물이 상대전극에서 역전처리(reverse electrolysis)되지 않도록 상대전극을 이온교환막이나 세라믹 필터 등으로 분리된 격막 내에 설치하기도 합니다. 또한, 상대전극에서 반응물로 발생되는 수소나 산소는 용액의 pH에 변화를 가져올 수 있습니다. 그러나 Cyclic voltammetry 실험과 같은 전기화학 실험에서는 상대전극에서 생성된 물질이 확산되어 작업전극에서 일어나는 반응에 영향을 끼치기에는 작업전극에서의 반응 시간이 짧기 때문에 상대전극을 분리시킬 필요는 없습니다.
3전극 시스템으로 임피던스 실험을 할 경우에는 기준전극과 작업전극 사이에서의 전기화학적 특성들이 측정되는 것이며 2전극 시스템의 경우에는 작업전극 및 상대전극에서의 전기화학적 특성들을 측정하게 됩니다.
탄소를 포함한 다양한 재질이 상대전극으로 사용될 수 있습니다. 만약 상대전극에서 산화반응이 일어난다면, 특히 실험 시간이 길 경우 부식 속도가 낮는 재질을 선택하는 것이 중요합니다. 상대전극으로 백금 전극을 사용할 경우 상대전극에서 생성된 Pt 이온이 작업전극으로 이동하여 실험데이터에 영향을 끼친 사례가 보고된 바 있습니다. 탄소 전극은 산화반응이 일어나는 상대전극으로 사용되기에 적합한 적극으로 선택되고 있습니다. 상대전극에서 수소가 발행하는 실험이라면 니켈(nickel)이나 강철(steel)이 고가인 백금의 대체품으로 사용되기도 합니다
IDA 전극(Interdigitated Array Electrode) 은 cyclic voltammetry 실험을 포함한 일반 전기화학, 크로마토그래피 실험을 통한 분석물질의 검출, 반응 분석(reaction analysis) 등의 분야에서 널리 사용되고 있습니다. IDA 전극은 lithographic 테크닉을 이용하여 제작된 미소전극(microelectrode)으로 기존의 인쇄방식의 전극(screen-printed electrodes)와 비교하여 높은 재현성, 높은 민감도와 빠른 결과를 얻을 수 있습니다.
IDA 전극의 구조는 아래 그림에서 보시는 바와 같이 쌍을 이룬 microband 전극이 수 um의 gap을 두고 나열된 형태로 쌍(pair)의 수는 수 십 또는 수 백 개에 이르기도 합니다. 쌍을 이루는 microband 전극(WE1(generator) & WE2(collector)은 각각 전압 제어가 가능하며 만약 이 둘 중 WE1(generator)에서 산화종이 생성되었다면, 이 산화종은 수 um 떨어진 그 옆에 위치한 WE2(collector)로 확산되어 가서 다시 환원되고, 이 환원종은 확산되어 다시 원래의 전극 쪽으로 이동하게 됩니다. 이를 ‘Redox Cycling’이라 하고 이러한 과정에서 전극을 통해 전류가 흐르게 됩니다. Generator와 collector의 gap이 좁아지면 측정 전류는 증가하게 됩니다. Redox cycling에 대해서는 아래에서 다시 추가 설명을 드리도록 하겠습니다.
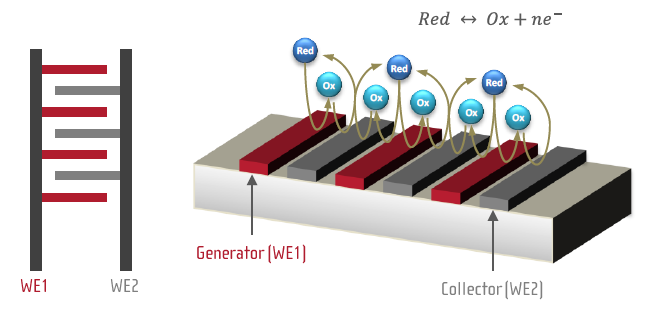
그림 1) IDA 전극의 기본 구조 및 Redox Cycling
(출처: IDA Microelectrode approach by Micrux Technologies)
일반적으로는 IDA 전극을 potentiostat에 연결하여 CV(cyclic voltammetry)실험을 하게 됩니다. 보통 2가지 모드에서 실험을 하게 되는데 만약 WE1에만 전압을 주사하여 CV 실험을 하고 WE2는 회로에 연결하지 않는다면 이를 single mode라고 하고 2개의 작업전극(WE1과 WE2) 모두에서 전압을 제어하며 실험한다면 이를 double mode라고 합니다.
Double mode에서 2개의 작업전극(WE1과 WE2)을 함께 제어하여야 하기 때문에 bi-potentiostat를 이용하여야 합니다. 만약 용액에 환원종이 존재하는 환경이라면 WE2(collector)는 산화환원전위(redox potential)보다 조금 낮는(보통 E°-100mV) 전압에 고정시키고, WE1(generator)에는 전압을 주사(scan)하게 됩니다.
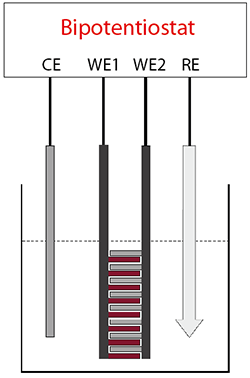
그림 2) dual mode 실험을 위한 셋업
(CE: 상대전극, WE1: generator, WE2: collector, RE: 기준전극)


그림 3) 왼쪽: dual mode에서의 redox cycling
오른쪽: single mode에서는 산화반응
(출처: IDA electrode by ALS Co., Ltd.)
Single mode에서 실험을 할 경우 위에 설명한 바와 같이 WE1에만 전압을 주사하게 되고 그림 4)에서와 같은 S자형 그래프를 얻게 됩니다. Double mode에서는 WE1과 WE2가 모두 전압 제어되며 기본적으로 WE1과 WE2의 전극 크기는 같고 dual mode에서의 전류 크기는 single mode에서의 전류 크기보다 더 크게 됩니다. 그림 1)의 오른쪽 그림에서 보듯이 dual mode에서 산화환원반응은 인접한 전극들 사이에서 일어나며 한 쪽 전극에서 생성된 물질이 인접한 다른 전극에서 일어날 반응의 재료가 됩니다. 이러한 과정을 “Redox Cycling”이라고 합니다. 이때 redox cycle number는 그림 4)에서 한계전류 Ia 또는 Ic와 Io의 비로 정의할 수 있습니다. 전극의 크기가 작을수록 더 높은 redox cycle number를 얻을 수 있고 redox cycle number가 증가하면 더 큰 전류가 흐르게 됩니다. Single mode와 double mode에서의 전류 값은 크게는 30배까지 차이가 나기도 합니다. (그림 5)
Double mode에서 redox cycling에 의해 전류가 커지는 동안, 고정된 전압이 인가되고 있는 WE2에서는 용량형 충전전류(capacitive charging current)가 없기 때문에 신호대잡음비(signal-to-noise ratio)가 향상되게 됩니다. 일반적인 cyclic voltammetry 실험에서는 충전전류(charging current)는 전압 주사 속도에 비례하고, faradaic current는 주사 속도의 제곱근(ν1/2)에 비례합니다. 즉, 주사 속도가 크면 클수록 신호대잡음비는 나빠지게 됩니다. 그러나 IDA전극을 이용한 dual mode에서의 실험을 할 경우 WE2의 전압이 고정되어 있기 때문에 WE2에서의 충전 전류가 발생하지 않습니다. 따라서, 주사 속도가 빠르더라도 충전전류의 영향을 받지 않습니다. 이러한 이유로 IDA 전극은 고속 주사 voltammetry 실험에 적합합니다. 또한, dual mode에서는 산화환원반응이 반복적으로(redox cycling) 일어나기 때문에 single mode에서와 같이 반응물이 소진되는 경우는 일어나지 않습니다.
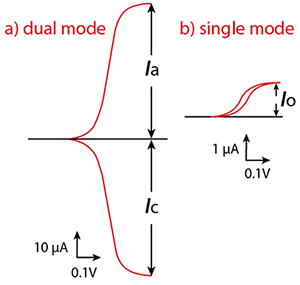
그림 4) IDA 전극을 이용해 얻는 전형적인 voltammogram
a: dual mode
b: single mode
Ia & Ic: WE1(generator)와 WE2(collector)에서의 한계전류(steady-state limiting current),
I0: single mode에서의 한계전류
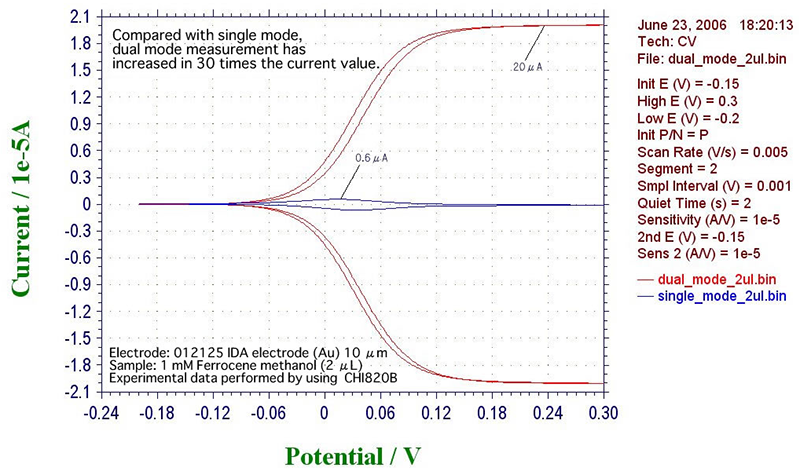
그림 5) single mode와 double mode에서의 전류 값 비교
(출처: IDA electrode by ALS Co., Ltd.)
IDA전극은 전극 간 gap이 좁을수록 높은 민감도와 짧은 반응 시간을 나타냅니다. 또한, 샘플 양이 적어도 실험이 가능합니다. 이러한 이유로 생물물질(biological substance)의 검출이나 액체크로마토그래피(liquid chromatography, LC) 및 유동 주입 분석(flow injection analysis, FIA)에서의 물질 검출에 적합한 전극입니다. 예를 들어, IDA 전극을 이용한 dual mode에서의 실험으로 중요 신경 전달 물질 중 하나인 도파민(dopamine)의 정량 분석이 가능합니다. 이 실험 과정에서 생성되는 아스코르브산(ascorbic acid)과 같은 간섭물질을 한 쪽 전극에서 산화시켜 전기화학적으로 불활성을 띄는 물질로 바꿈으로써 그 영향을 제거할 수 있습니다. 또한, 산화된 상태의 도파민은 매우 불안정한데 산화된 도파민이 산화환원반응에 불활성한 형태로 바뀌기 전에 gap이 충분히 좁은 IDA 전극을 사용하여 인근 전극에서 빠르게 환원시킴으로써 도파민을 정량 분석할 수 있습니다. 100pM의 도파민을 검출했다는 결과가 보고 되기도 하였으며1), 탄소 IDA 전극과 microbore LC 시스템을 이용하여 sub-femtomole 농도의 도파민 검출 기록도 보고 되었습니다.2)
IDA 전극은 lithography 테크닉을 이용하여 제조되기 때문에 전극 모양을 다양하게 디자인할 수있으며 부반응에 의해 생성된 물질 중 목표 물질에 대한 선택성을 높일 수 있도록 전극을 디자인할 수 있는 장점이 있습니다. 그 외, 전압 강하가 크게 일어나 매크로 전극을 사용하기 부적합한 비극성 용매, 저전도도성 용매, 이온전도성 폴리머 실험에 적용 가능합니다. 효소 수정 전극(enzyme modified electrode)을 이용한 실험이나 전기화학반응을 수반하는 면역 반응 실험에도 사용 가능합니다.
1) M. Takahashi, M. Morita, O. Niwa, and H. Tabei, J. Electroanal. Chem. 335 (1992) 253.
2) H. Tabei, M. Takahashi, S. Hoshino, O. Niwa, and T. Horiuchi, Anal. Chem. 66 (1994) 3500.
유기용매를 사용하는 경우에는 흔히 사용하는 Ag/AgCl 기준전극에서와 같이 물(H2O)에 염을 녹인 전해액을 사용한 전극을 사용할 수가 없습니다. 이러한 전극을 사용할 경우 액간전위차(liquid-liquid junction potential)가 생길 수 있으며 실험 샘플이 전극 내부의 용액에 의해 오염될 가능성도 있습니다. 뿐만 아니라 장시간 측정 시 기준전극의 전위 자체가 안정된 상태로 유지되지 못하는 것으로 알려져 있습니다. 이것에 대한 대응책으로 Ag/Ag+ 기준전극을 쓰는 방법이 있고 또 한가지는 Pt나 Ag 선을 이용한 pseudo 기준전극을 사용하는 방법이 있습니다. 이번 자료에서는 비수용성 용액에서 사용할 수 있는 기준전극에 대해 알아보도록 하겠습니다.
Ag/AgNO3 (10mM AgNO3 in MeCN)
AgNO3 + e- ⇌ Ag(s) + NO3- (E° = 0.541V vs. NHE)
Ag/Ag+ 기준전극의 기본적인 구조는 지지 전해질인 TBAP(tetrabutylammonium perchlorate), TEAP(tetraethylammonium perchlorate), (TBA)PF6(tetrabutylammonium hexafluorophosphate) 등을 ACN(acetonitrile), DMF(dimethylformamide), DMSO(dimethylsulfoxide) 등의 용매에 녹인 것을 사용하며, silver ion 공급원으로 AgNO3, AgClO4 등을 용액에 녹여 사용합니다. acetonitrile(ACN)은 negative potential 영역에서 주로 사용되는 용매이고 dimethylsulfoxide (DMSO)는 positive potential 영역에서 주로 사용되는 용매입니다.
Ag/Ag+ 기준전극의 전위는 용매, Ag+의 농도, 지지전해질의 특성이나 농도에 영향을 받습니다. 예를 들어 Ag+는 acetonitrile 내에서 매우 강하게 용매화(solvated) 되기 때문에 acetonitrile을 용매로 사용할 경우에 안정적인 potential을 갖습니다. 그러나 propylene carbonate(PC) 또는 nitromethane(NM)에서는 Ag+가 잘 녹지 않기 때문에 potential이 안정하지 않으며 용매에 녹아 있는 다른 불순물에 의해 영향을 많이 받습니다. dimethylformamide(DMF)에서는 Ag+가 점차적으로 Ag로 환원되는 현상이 나타나며 이에 따라 potential이 negative 방향으로 이동하는 결과를 낳습니다. 아래 표 1)에서 몇 가지 대표적인 유기용매에 대한 Ag/Ag+ 기준전극의 적합 여부를 확인하실 수 있습니다.
| 전극/용매 | ACN | AN | PC | NM | TMS | DMSO | DMF | NMP |
|---|---|---|---|---|---|---|---|---|
| Ag/Ag+ | G | G | F | F | F | G | F | F |
표 1) G: 일반적 용도로 사용 가능, F: 제한된 조건에서 사용 가능
출처: Electrochemistry in nonaqueous solutions written by Prof. Dr. Kosuke Izutsu
Ag/AgNO3 전극의 단점은 빛에 민감하고 산소가 존재하는 환경에서 Ag2O가 생성되어 이것이 Ag/Ag+의 산화환원 반응을 방해하는 요인이 되고 결과적으로 전극 자체의 potential이 불안정하게 되는 요인으로 작용할 수 있습니다. 또한, Ag+이 전극 밖으로 쉽게 확산되어 나오기 때문에 연구하려는 주요 반응에 영향을 미칠 수도 있습니다. 이러한 Ag+의 누수를 최소화하기 위해 double junction 형태의 전극으로 사용하거나 염다리(salt bridge)를 사용하기도 하나 이럴 경우 액간전위차(liquid-liquid junction potential)가 증가하는 결과를 초래하기도 합니다. 뿐만 아니라, 매 실험 전 내부 용액 등을 새것으로 바꿔 새롭게 전극을 준비하여 하는 번거로움이 있습니다. 또한, 자체 potential이 다른 기준전극과 비교하여 그리 안정적이지 않기 때문에 internal standard를 사용하기도 합니다. 이에 대해서는 아래에서 다시 다루겠습니다.
Ag/Ag+ 기준용액의 내부 용액을 만들어 전극을 준비하는 과정을 보시려면 여기1)를 클릭하여 주십시오. 시중에는 acetonitrile(ACN)에 0.1 M tetrabutylammonium perchlorate(TBAP)과 0.01 M AgNO3를 녹인 용액, Ag 선, 다공성 막이 달린 glass tube 등을 판매하고 있어 손쉽게 Ag/Ag+ 기준전극을 만들어 사용하실 수 있습니다.2)
Ag/Ag2O Pseudo (Electrolyte)
Ag2O(s) + H2O + 2e- ⇌ 2Ag(s) + 2OH- (E° = 0.344 vs. NHE)
Pseudo 기준전극은 주로 백금(Pt)이나 은(Ag)와 같은 금속 wire를 사용하며 단순히 potential 차이만 측정하고자 할 때 적합한 기준전극입니다. 백금(Pt) wire 보다는 은(Ag) wire가 더 많이 사용되는데 이는 쉽게 산화되는 Ag의 특성 때문으로 산화막(AgO)으로 둘러싸이고 나면 그 자체의 potential을 형성하여 ferrocene과 같은 첨가물에도 좀처럼 기준전위가 변하지 않기 때문입니다.
pseudo 기준전극은 Ag/AgCl, SCE와 같은 기준전극과 달리 시스템마다 다른 전위를 나타내며 pH, 전극 재질, 샘플 용액, 온도 등에 영향을 많이 받습니다. 실험을 시작하고 전기화학 반응이 일어남에 따라 전해액의 조성에 변화가 발생할 수도 있습니다. 또한, 금속 표면에 생성되는 산화물 때문에 전극의 전위가 이동하는 현상을 보이게 됩니다. 이럴 경우 frit이 달린 유리관 안에 pseudo 전극을 넣어 전해액으로부터 격리하여 사용하는 것이 바람직합니다. 이와 같이 pseudo 기준전극은 실험 중 여러 요인으로 전위의 이동이 일어날 수 있는데 이를 보정하기 위해 실험의 끝 부분에 전위가 잘 알려진 redox couple (internal standard) 를 첨가하여 다시 한번 측정하게 됩니다. 뿐만 아니라, pseudo 기준전극은 실험하기에 앞서 적어도 1시간 정도 실험 용액에 담궈 안정화시키는 것이 좋습니다.
pseudo 기준전극의 이러한 몇 가지 단점에도 불구하고 다음과 같은 장점 때문에 널리 쓰이고 있습니다. 전해액에 바로 담궈 사용할 수 있고, Ohmic resistance (impedance) 효과가 적고, 액간전위차(liquid-liquid junction potential)이 없고, 기존 기준전극들과 비교하여 전극의 내부용액에 의한 오염을 고려하지 않아도 됩니다. 또한, 비수용성 용매뿐만 아니라 용융염(molten salts), 온도가 급격히 상승하는 계(system), 이온성 액체(ionic liquid)에서도 사용이 가능합니다.
Ag/Ag+ 기준전극이나 pseudo 기준전극의 전위를 보정하기 위해 사용되는 redox couple을 internal standard라 부르며 대표적으로 ferrocene 또는 cobaltocene 등이 사용됩니다. 이들은 유기용매에서도 잘 녹고, 뛰어난 가역 반응성을 보이는 특성을 갖고 있습니다. 매우 안정적인 전위를 갖기 때문에 그 자체로 pseudo 기준전극으로 쓰이기도 합니다. ferrocene을 넣은 이후에도 연구하고자 하는 산화-환원 반응의 전위가 변하지 않으면, ferrocene peak을 기준으로 사용할 수 있습니다. 논문에 게재할 경우 vs. Fc/Fc+ Fc/Fc+ in [solvent/electrolyte system]를 적어 ferrocene/ferricenium의 전위에 대한 값을 표시하게 됩니다. 만약 ferrocene의 산화/환원 peak가 분석물의 peak와 겹친다면 다른 internal standard를 사용하여야 합니다. (예: dichloromethane(CH2Cl2) 용액에서 Ag/Ag+ 기준전극(AgNO3 (10 mM) in 0.1 M Bu4NClO4-MeCN)의 전위가 -0.13V일 경우 -0.13 V in CH2Cl2 vs. ferrocene/ferrocenium (Fc/Fc+) couple 과 같이 표시)

REFERENCE